보건복지부, '신의료기술평가에 관한 규칙' 개정안 입법 예고
앞으로 새로 개발된 의료기기가 시장에 진입하는 데 걸리는 시간이 단축되어 환자 진료가 조속히 이뤄질 것으로 보인다.
보건복지부는 7일 신의료기술평가와 보험등재심사를 동시에 진행하는 ‘신의료기술평가에 관한 규칙’ 개정안을 입법 예고한다고 밝혔다.
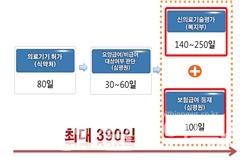
그동안 새롭게 개발된 의료기기가 보험에 등재되려면 식품의약품안전처 허가 후에도 급여 여부를 확인하는 절차를 밟고, 신의료기술평가를 거쳐야 했기 때문에 시장 진입이 늦어졌다.
반면 개정안은 새로운 기술이 시장에 진입하기 전에 거쳐야 하는 신의료기술평가와 건강보험 급여 대상인지를 확인하는 보험등재심사를 동시에 진행해 시장 진입 기간을 단축할 수 있다.
즉, 신의료기술평가 시 한국보건의료연구원에 보험급여 등재를 위한 자료를 제출하면 건강보험심사평가원의 보험등재심사도 자동 진행되면 신의료기술평가와 보험급여 등재심사가 동시에 종료될 수 있는 것이다. 따라서 신개발 의료기기 시장 진입 기간은 최대 490일에서 390일로 줄어들 전망이다.
손호준 복지부 의료자원정책과장은 “신개발 의료기기의 시장 진입 기간이 100일가량 단축돼 그간 시장 진입 기간이 길어져 발생했던 업계의 어려움이 상당 부분 해소될 것”이라고 설명했다.
한편, 개정안 입법예고 기간은 오는 9일부터 다음 달 16일까지 40일간이다. 복지부는 이 기간에 국민 의견을 수렴한 후 개정안을 확정할 예정이다.
천혜민 기자
hyemin@healthinnews.co.kr

