이번 연구 성과는 과학기술정보통신부·한국연구재단에서 추진하는 중견연구자지원사업과 바이오·의료기술개발사업의 지원으로 수행되었고, 생화학 및 분자생물학 분야의 세계적 권위지인 ‘Molecular Cell (impact factor, 15.584)’에 개재됐다.
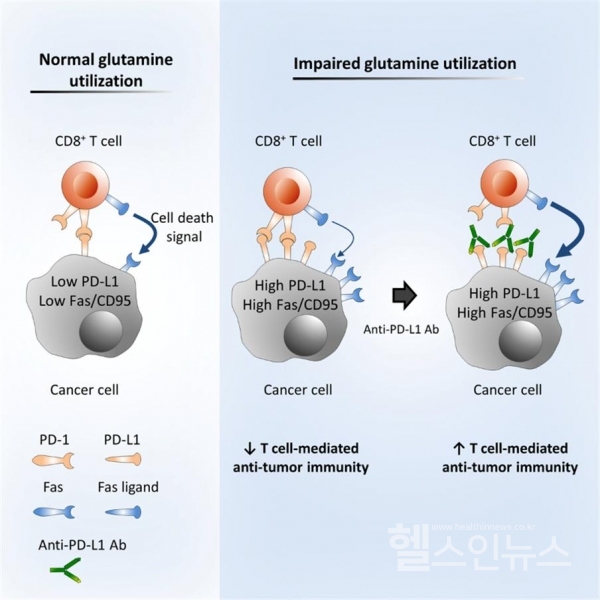
연구팀은 글루타민이 결핍된 종양미세환경에 노출된 암세포는 성장은 둔화되지만 면역회피 단백질로 알려진 PD-L1의 발현이 증가하여 T-림프구의 항종양 면역반응을 회피하여 생존할 수 있음을 발견하고, 글루타민 억제제와 항PD-L1 항체를 병용하였을 때 T-림프구에 의한 암세포 사멸이 증가하면서 종양 크기가 단독 투여에 비해 크게 감소함을 밝혔다.
반면, 암 대사 연구 기법의 발전으로 글루타민 대사를 제어하는 전략이 유망한 치료적 접근법으로 여겨졌지만 임상 진입에는 한계를 보였다. 연구팀은 글루타민 대사 억제제가 면역결핍 마우스에서는 뚜렷한 항암효과가 있지만, 면역기능이 정상인 마우스에서는 그 효과가 상쇄된다는 점에 착안하여 글루타민 대사 억제가 면역세포의 항종양 면역 반응에 미치는 영향을 밝히고자 했다.
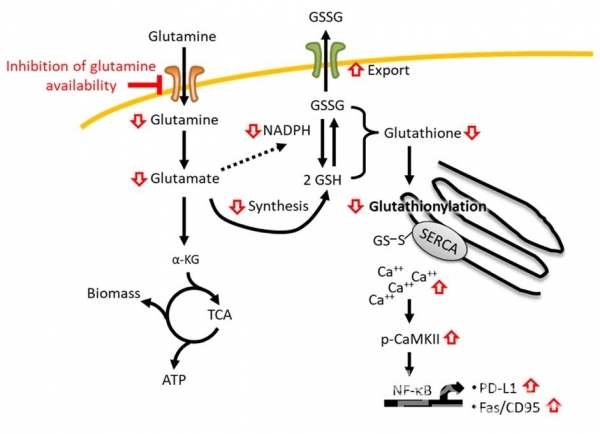
연구 결과, 글루타민 대사를 억제하거나 글루타민 수송을 차단하였을 때 암세포의 PD-L1 발현이 상향 조절됨으로써 T-림프구의 항종양 면역 반응을 저해함을 밝혔으며, 암세포에서 글루타민 대사를 억제할 경우 칼슘 펌프(SERCA) 활성 저해와 칼슘 신호전달체계의(calcium/NF-κB) 활성화로 면역회피 단백질인 PD-L1과 세포사멸 유발 단백질(Fas/CD95)이 모두 상향 조절됨을 규명했다.
임혜정 기자
webmaster@healthinnews.co.kr





